QUÍMICA ORGÂNICA II
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Lewis. Pois segundo a definição de Lewis:
Um ácido é considerado como um nucléofilo.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com carga positiva. Com relação aos carbocátions abaixo, assinale a alternativa correta:
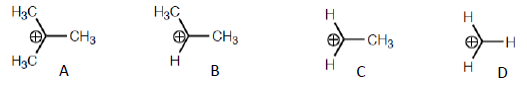
O carbocátion D é classificado como carbocátion terciário.
Um carbocátion pode ser atacado por um nucleófilo.
Um carbocátion secundário é sempre mais estável que um carbocátion terciário.
Um carbocátion primário é o mais estável dos carbocátions representados acima.
Quanto menos grupos CH3 em volta do carbono positivo mais estável é o composto.
O princípio ativo do Prozac é o cloridrato de fluoxetina e ele faz parte de um grupo de medicamentos chamados de inibidores seletivos da recaptura da serotonina. A serotonina é um dos neurotransmissores do cérebro e atua na comunicação entre as células nervosas e os neurônios. Inibindo a sua recaptura pelas células nervosas, o Prozac aumenta o nível de serotonina disponível no cérebro o que facilita a transmissão da informação entre os neurônios e alivia os sintomas da depressão. Analisando a estrutura química do Prozac, uma droga antidepressiva, é VERDADEIRA a afirmação:
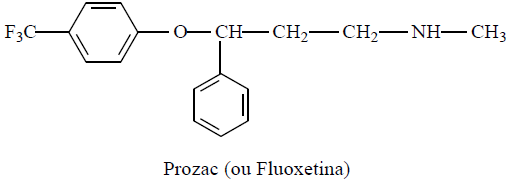
Os átomos de flúor caracterizam um composto ácido.
A função éter caracteriza um composto com propriedades básicas.
A amina presente na estrutura e que caracteriza um composto básico é primária.
É uma droga com propriedades ácidas devido à presença do grupamento aromático.
É uma droga com propriedades básicas devido à presença da amina secundária.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
H3O+ e OH
NH3 e H3O+
H2O e NH4+
NH3 e OH
NH3 e NH4+
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Benzóico.
Propanóico.
γ-iodo pentanóico.
β-cloro butanóico.
Monocloro acético.
Os ácidos carboxílicos e os fenóis, devido ao seu caráter ácido, quando reagem com bases inorgânicas levam à formação de seus respectivos sais orgânicos. Sendo assim, quando ocorrer a reação do ácido butanoico com o hidróxido de potássio, qual será o sal formado?
Butanoato de sódio.
Etanoato de sódio.
Propanoato de potássio.
Etanoato de potássio.
Butanoato de potássio.
A presença de uma cadeia de carbonos mais longa em um ácido carboxílico faz com que o caráter polar deste diminua e tenha como consequência a diminuição da sua ionização e da sua acidez. Portanto, verifica-se que a acidez vai diminuindo com o aumento da cadeia de carbonos. Sendo assim, marque a alternativa que apresenta o ácido de menor acidez.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
Um ácido é considerado como um nucléofilo.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com carga positiva. Com relação aos carbocátions abaixo, assinale a alternativa correta:
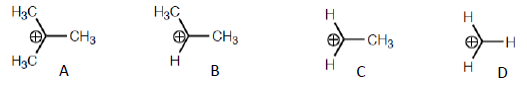
O carbocátion D é classificado como carbocátion terciário.
Um carbocátion pode ser atacado por um nucleófilo.
Um carbocátion secundário é sempre mais estável que um carbocátion terciário.
Um carbocátion primário é o mais estável dos carbocátions representados acima.
Quanto menos grupos CH3 em volta do carbono positivo mais estável é o composto.
O princípio ativo do Prozac é o cloridrato de fluoxetina e ele faz parte de um grupo de medicamentos chamados de inibidores seletivos da recaptura da serotonina. A serotonina é um dos neurotransmissores do cérebro e atua na comunicação entre as células nervosas e os neurônios. Inibindo a sua recaptura pelas células nervosas, o Prozac aumenta o nível de serotonina disponível no cérebro o que facilita a transmissão da informação entre os neurônios e alivia os sintomas da depressão. Analisando a estrutura química do Prozac, uma droga antidepressiva, é VERDADEIRA a afirmação:

Os átomos de flúor caracterizam um composto ácido.
A função éter caracteriza um composto com propriedades básicas.
A amina presente na estrutura e que caracteriza um composto básico é primária.
É uma droga com propriedades ácidas devido à presença do grupamento aromático.
É uma droga com propriedades básicas devido à presença da amina secundária.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
H3O+ e OH
NH3 e H3O+
H2O e NH4+
NH3 e OH
NH3 e NH4+
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Benzóico.
Propanóico.
γ-iodo pentanóico.
β-cloro butanóico.
Monocloro acético.
Os ácidos carboxílicos e os fenóis, devido ao seu caráter ácido, quando reagem com bases inorgânicas levam à formação de seus respectivos sais orgânicos. Sendo assim, quando ocorrer a reação do ácido butanoico com o hidróxido de potássio, qual será o sal formado?
Butanoato de sódio.
Etanoato de sódio.
Propanoato de potássio.
Etanoato de potássio.
Butanoato de potássio.
A presença de uma cadeia de carbonos mais longa em um ácido carboxílico faz com que o caráter polar deste diminua e tenha como consequência a diminuição da sua ionização e da sua acidez. Portanto, verifica-se que a acidez vai diminuindo com o aumento da cadeia de carbonos. Sendo assim, marque a alternativa que apresenta o ácido de menor acidez.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
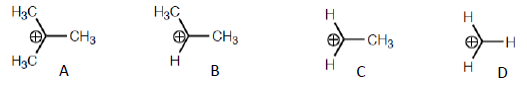
O carbocátion D é classificado como carbocátion terciário.
Um carbocátion pode ser atacado por um nucleófilo.
Um carbocátion secundário é sempre mais estável que um carbocátion terciário.
Um carbocátion primário é o mais estável dos carbocátions representados acima.
Quanto menos grupos CH3 em volta do carbono positivo mais estável é o composto.
O princípio ativo do Prozac é o cloridrato de fluoxetina e ele faz parte de um grupo de medicamentos chamados de inibidores seletivos da recaptura da serotonina. A serotonina é um dos neurotransmissores do cérebro e atua na comunicação entre as células nervosas e os neurônios. Inibindo a sua recaptura pelas células nervosas, o Prozac aumenta o nível de serotonina disponível no cérebro o que facilita a transmissão da informação entre os neurônios e alivia os sintomas da depressão. Analisando a estrutura química do Prozac, uma droga antidepressiva, é VERDADEIRA a afirmação:

Os átomos de flúor caracterizam um composto ácido.
A função éter caracteriza um composto com propriedades básicas.
A amina presente na estrutura e que caracteriza um composto básico é primária.
É uma droga com propriedades ácidas devido à presença do grupamento aromático.
É uma droga com propriedades básicas devido à presença da amina secundária.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
H3O+ e OH
NH3 e H3O+
H2O e NH4+
NH3 e OH
NH3 e NH4+
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Benzóico.
Propanóico.
γ-iodo pentanóico.
β-cloro butanóico.
Monocloro acético.
Os ácidos carboxílicos e os fenóis, devido ao seu caráter ácido, quando reagem com bases inorgânicas levam à formação de seus respectivos sais orgânicos. Sendo assim, quando ocorrer a reação do ácido butanoico com o hidróxido de potássio, qual será o sal formado?
Butanoato de sódio.
Etanoato de sódio.
Propanoato de potássio.
Etanoato de potássio.
Butanoato de potássio.
A presença de uma cadeia de carbonos mais longa em um ácido carboxílico faz com que o caráter polar deste diminua e tenha como consequência a diminuição da sua ionização e da sua acidez. Portanto, verifica-se que a acidez vai diminuindo com o aumento da cadeia de carbonos. Sendo assim, marque a alternativa que apresenta o ácido de menor acidez.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.

Os átomos de flúor caracterizam um composto ácido.
A função éter caracteriza um composto com propriedades básicas.
A amina presente na estrutura e que caracteriza um composto básico é primária.
É uma droga com propriedades ácidas devido à presença do grupamento aromático.
É uma droga com propriedades básicas devido à presença da amina secundária.
Considerando a teoria de Bronsted-Lowry, ácido é toda espécie capaz de doar próton (H+) e base é toda espécie química capaz de receber próton (H+). Na reação a seguir:
NH3 + H2O ↔ NH4+ + OH- Quais espécies podem ser consideradas bases de Bronsted-Lowry?
H3O+ e OH
NH3 e H3O+
H2O e NH4+
NH3 e OH
NH3 e NH4+
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Benzóico.
Propanóico.
γ-iodo pentanóico.
β-cloro butanóico.
Monocloro acético.
Os ácidos carboxílicos e os fenóis, devido ao seu caráter ácido, quando reagem com bases inorgânicas levam à formação de seus respectivos sais orgânicos. Sendo assim, quando ocorrer a reação do ácido butanoico com o hidróxido de potássio, qual será o sal formado?
Butanoato de sódio.
Etanoato de sódio.
Propanoato de potássio.
Etanoato de potássio.
Butanoato de potássio.
A presença de uma cadeia de carbonos mais longa em um ácido carboxílico faz com que o caráter polar deste diminua e tenha como consequência a diminuição da sua ionização e da sua acidez. Portanto, verifica-se que a acidez vai diminuindo com o aumento da cadeia de carbonos. Sendo assim, marque a alternativa que apresenta o ácido de menor acidez.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
H3O+ e OH
NH3 e H3O+
H2O e NH4+
NH3 e OH
NH3 e NH4+
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Benzóico.
Propanóico.
γ-iodo pentanóico.
β-cloro butanóico.
Monocloro acético.
Os ácidos carboxílicos e os fenóis, devido ao seu caráter ácido, quando reagem com bases inorgânicas levam à formação de seus respectivos sais orgânicos. Sendo assim, quando ocorrer a reação do ácido butanoico com o hidróxido de potássio, qual será o sal formado?
Butanoato de sódio.
Etanoato de sódio.
Propanoato de potássio.
Etanoato de potássio.
Butanoato de potássio.
A presença de uma cadeia de carbonos mais longa em um ácido carboxílico faz com que o caráter polar deste diminua e tenha como consequência a diminuição da sua ionização e da sua acidez. Portanto, verifica-se que a acidez vai diminuindo com o aumento da cadeia de carbonos. Sendo assim, marque a alternativa que apresenta o ácido de menor acidez.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
Benzóico.
Propanóico.
γ-iodo pentanóico.
β-cloro butanóico.
Monocloro acético.
Os ácidos carboxílicos e os fenóis, devido ao seu caráter ácido, quando reagem com bases inorgânicas levam à formação de seus respectivos sais orgânicos. Sendo assim, quando ocorrer a reação do ácido butanoico com o hidróxido de potássio, qual será o sal formado?
Butanoato de sódio.
Etanoato de sódio.
Propanoato de potássio.
Etanoato de potássio.
Butanoato de potássio.
A presença de uma cadeia de carbonos mais longa em um ácido carboxílico faz com que o caráter polar deste diminua e tenha como consequência a diminuição da sua ionização e da sua acidez. Portanto, verifica-se que a acidez vai diminuindo com o aumento da cadeia de carbonos. Sendo assim, marque a alternativa que apresenta o ácido de menor acidez.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
Butanoato de sódio.
Etanoato de sódio.
Propanoato de potássio.
Etanoato de potássio.
Butanoato de potássio.
A presença de uma cadeia de carbonos mais longa em um ácido carboxílico faz com que o caráter polar deste diminua e tenha como consequência a diminuição da sua ionização e da sua acidez. Portanto, verifica-se que a acidez vai diminuindo com o aumento da cadeia de carbonos. Sendo assim, marque a alternativa que apresenta o ácido de menor acidez.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
Ácido etanoico
Ácido butanoico
Ácido propanoico
Ácido metanoico
Ácido pentanoico
A basicidade das aminas está relacionada com a disponibilidade do par de elétrons do nitrogênio a ser doado para outra espécie, ou seja, quanto mais disponível o par de elétrons mais básica é a amina. Dentre as alternativas a baixo, marque a que apresenta a amina de maior basicidade.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
Fenilamina
Amônia
Trietilamina
Dimetilamina
Metilamina
Quando um ácido carboxílico ou fenol reagem com uma base em meio aquoso, levam à formação do seu respectivo sal orgânico. Sendo assim a reação entre o ácido pentanoico e hidróxido de lítio leva a formação do:
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
Pentanoato de lítio
2-metil-butanoato de lítio
Pentanoeto de lítio
Pentanoato de sódio
2-etil-propanoato de lítio
As aminas caracterizam-se por sua basicidade. Em solução aquosa são capazes de gerar íons OH- deixando o meio básico, enquanto que os ácidos carboxílicos e fenóis em solução aquosa geram íons H+ deixando o meio ácido. Considerando as afirmações anteriores, marque a alternativa correta que corresponde a origem da basicidade das aminas.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.
As aminas são bases de Lewis, pois o nitrogênio possui um par de elétrons livres.
As aminas são bases de Lewis, pois o nitrogênio recebe um próton.
As aminas são bases de Lewis, pois o nitrogênio recebe um par de elétrons livres do oxigênio.
As aminas são bases de Arrhenius, pois o nitrogênio libera uma hidroxila em meio aquoso.
As aminas são bases de Bronted-Lowry, pois o nitrogênio doa um próton.